台湾大学医学院分子医学研究所李芳仁教授的研究团队日前发表创新论文,首度揭开诱发细胞中内质网(Endoplasmic reticulum,ER)压力会进一步调控高基氏体(Golgi apparatus)的讯息传递及囊泡运输。此新发现将提供研究内质网压力引发相关疾病的硏究新方向。该论文于2016年3月10日刊登于自然科学领域重要国际期刊“美国国家科学院期刊”(Proceedings of the National Academy of Sciences ),并受到国际重视。
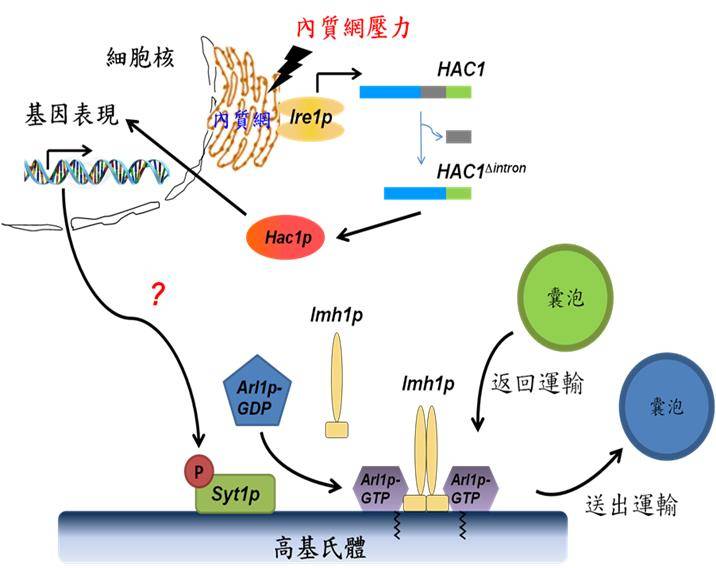
内质网是细胞内极重要的蛋白质与脂类的合成包装运输起点。在内质网内制造出的蛋白质先被折叠(folding)、加工和修饰,再被运输到高基氏体进行再修饰与分类包装,最后以囊泡运输到细胞膜上或分泌到细胞外,此机制的运作攸关生物的生命能否正常延续。细胞若受到外来环境的压力或内在基因的变异,会导致蛋白质折叠不正常,这些异常蛋白质若累积在内质网内,会形成内质网压力(ER stress),并造成蛋白质折叠不正常反应(unfolded protein response, UPR)上升。过去已有许多文献报导指出很多疾病都和内质网压力有关,例如:阿兹罕默症、帕金森氏症、糖尿病与癌症等。因此,剖析细胞对于蛋白质折叠不正常反应的调控,对于了解细胞生理以及人类疾病具有重大的意义。
李教授实验室长期以单细胞酵母菌(Saccharomyces cerevisiae)为模式生物,专注于研究细胞中囊泡运输的调控机制。过去实验室相关研究已证实小分子GTP水解酶Arl1p在细胞中囊泡运输过程扮演重要角色,且其活化过程需要GTP交换因子Syt1p参与。然而,Syt1p在高基氏体活化Arl1p的过程及分子机制仍不清楚。本篇研究首度提出内质网压力与高基氏体囊泡运输存在重要联结。当细胞累积过多未折叠蛋白质时,压力感受蛋白质Ire1p会被活化,使下游转录因子Hac1p顺利合成并引发基因表现,此讯息传递会进一步使GTP交换因子Syt1p被磷酸化。磷酸化的Syt1p与Arl1p蛋白质的交互作用增强,而可活化Arl1p,并使其下游高基氏体结构蛋白质Imh1p亦被召回高基氏体上。本篇论文揭示了未折叠蛋白质所诱发之内质网压力可以透过讯息传递而影响高基氏体上的蛋白质分布,并进一步调控其囊泡运输。了解高基氏体就未折叠蛋白质累积品质的管控机制及其受内质网压力的影响,将是实验室未来的研究重点。
李教授表示,过去的研究大都着墨于如何调控及缓解各种细胞中内质网内未折叠蛋白质的累积与相关疾病的研究,往往忽略了高基氏体管控的重要。本篇研究首开先河,指出细胞需要透过高基氏体囊泡运输之协助来释放内质网压力,对于内质网压力所引发相关疾病之分子机制提供崭新的研究方向。
本研究工作最重要的执行者博士后研究员许家维博士,计划由行政院科技部支持。
论文链接:http://www.pnas.org/content/early/2016/03/09/1518260113
(据台湾大学)
原创文章,如若转载,请注明出处。