干扰素α(IFN-α)在临床上被广泛用于治疗慢性肝炎和癌症,但是其体内循环半衰期很短(4-8小时),需要每天或一周三次大剂量给药,副作用很大,治疗效果也不理想。将IFN-α干扰素聚乙二醇化(PEGylation)后能够有效解决上述问题,如:罗氏公司的PEG化干扰素——PEGASYS,已在临床上广泛用于肝炎与癌症的治疗。但是PEGylation依然存在明显的缺点,如:产品的生物活性大幅度降低、生产工艺复杂、产率低、成本高等。此外,高分子PEG多次注射后会在体内产生免疫排斥反应,加快药物清除速率,从而导致治疗效果大幅下降。
日前,清华大学医学院生物医学工程系高卫平实验室在药剂学国际顶级期刊《控制释放期刊》(Journal of Controlled Release)上在线发表了题为《C端定点原位生长肿瘤治疗功效优于派罗欣的干扰素-磷脂类高分子偶联物》(In situ growth of a C-terminal interferon-alpha conjugate of a phospholipid polymer that outperforms PEGASYS in cancer therapy)的学术论文,在国际上首次报道定点原位生长(site-specific in situ growth, SIG)干扰素-磷脂类高分子偶联物(IFN-PMPC)。动物水平研究表明,该新型干扰素-磷脂类高分子偶联物比罗氏公司商品化药物派罗欣(PEGASYS)展现出更好的肿瘤治疗效果。高卫平研究员为本文的通讯作者,其博士生胡瑾为第一作者。
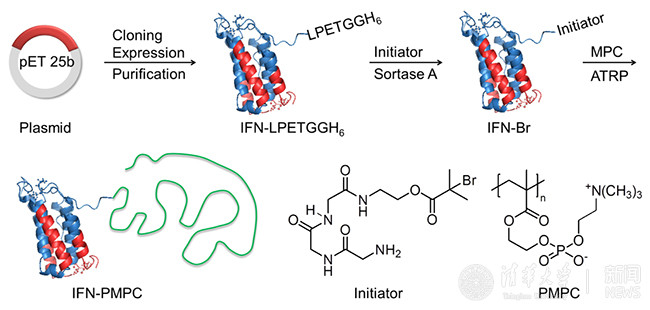
为了解决这些问题,高卫平实验室研发了定点原位生长技术(SIG)并将其应用于研发新一代干扰素-磷脂类高分子偶联物(IFN-PMPC)。SIG能够大幅度提高产率,有效降低成本。所用高分子PMPC是一种新型仿生材料,已经被美国FDA批准并广泛应用于生物医用领域。PMPC具有非常好的生物相容性和防蛋白吸附性能,多次注射后也不会引起体内免疫反应。通过SIG制备的IFN-PMPC的药代和生物分布与PEGASYS相似,但是其体外生物活性是PEGASYS的8.7倍。动物实验结果表明,IFN-PMPC不仅完全抑制了肿瘤的生长,而且治愈了75%的小鼠,而同样给药剂量的PEGASYS仅能在一定程度上抑制肿瘤生长,但不能治愈小鼠(图2a和2b)。这些实验结果表明,通过新一代SIG方法可以高效可控制备出比已在临床广泛使用的一线药物(PEGASYS)更好的新型蛋白药物,具有巨大的临床转化前景和社会经济价值。
高卫平实验室一直致力于蛋白质偶联物尤其是长效干扰素的研发,并且取得了一系列创新性研究成果,连续多次在国际顶级期刊《先进材料》(Advanced Materials)、《生物材料》(Biomaterials)、《控制释放期刊》(Journal of Controlled Release)、《化学通讯》(Chemical Communications)和《纳米尺度》(Nanoscale)等发表成果,相关工作已申请国际和国内发明专利7项。
高卫平实验室的研究重点是设计新型生物医用高分子、蛋白质偶联物以及纳米材料用于疾病的预防与诊疗。以上工作得到国家自然科学基金面上(21274043)和重点项目(21534006)的资助。
论文链接:http://www.sciencedirect.com/science/article/pii/S0168365916304321
(据清华大学)
原创文章,如若转载,请注明出处。